EL OXÍGENO Y EL NITRÓGENO
INTRODUCCIÓN
En el siguiente blog encontrarás todo acerca del oxígeno y el nitrógeno, desde su estado natural, sus propiedades, ya sean físicas o químicas, hasta su obtención, aplicación y temas como la combustión.
se realiza este blog ya que, gracias a éste es que los humanos nos mantenemos vivos. Es importante en la funcionalidad de nuestro organismo, y en muchos otros procesos que se realizan a base de esto o que simplemente lo necesitan, como nosotros.Veremos quién es y cuál fue el proceso que llevo Joseph Priestley y otros químicos para descubrir el oxígeno en 1774, el cual desde antes existía pero no sabíamos que esta sustancia fuera la base de la vida.
y no solo por el oxigeno, ya que en este trabajo se hablara del elemento nitrógeno (N), se relatara su pequeña historia identificando los distintos nombres que adopto hasta llegar a nitrógeno, se dará a conocer también todas sus propiedades físicas y químicas, donde se lo puede encontrar y los diferentes efectos que tiene en el cuerpo humano, los usos que este tiene en la parte industrial y como se lo puede transformar. Este trabajo se basara en estudios ya realizados e investigaciones.
OBJETIVOS
- OBJETIVO GENERAL
- Ampliar los conocimientos sobre la química mediante consultas acerca del nitrógeno y el oxígeno
- OBJETIVO ESPECÍFICOS
- Describir la historia y las generalidades del nitrógeno y el oxígeno.
- Consultar la interacción del nitrógenoy el oxígeno en el cuerpo humano, sus efectos favorables y nocivos en el organismo.
- Identificar los tratamientos y usos del nitrógeno y el oxígeno.
MARCO TEÓRICO
EL OXÍGENO Y EL NITRÓGENO
1.) ESTADO NATURAL
- Oxígeno:
El Oxígeno es el elemento más abundante de la superficie terrestre, de la cualforma casi el 50%; constituye un 89% del agua y un 23% del aire (porcentajes por pesos). En estado libre, el oxígeno se encuentra en la atmósfera en forma demoléculas diatónicas (O2), constituyendo un 23% por peso y un 21% por volumen.En combinación, entra en la formación de una gran cantidad de compuestosorgánicos y minerales, haciendo parte de todos los organismos animales yvegetales. De los minerales que contienen oxígeno, los más importantes son losque contienen silicio, siendo el más simple de todos la sílice (SiO2), que es elprincipal constituyente de la arena. Otros compuestos que contienen oxígeno sonsulfatos, carbonatos, fosfatos, nitratos y óxidos, principalmente.
-Nitrógeno:
El nitrógeno es el componente principal de la atmósfera del planeta Tierra, con el 78,1% de su volumen. Esta concentración es resultado del balance entre la fijación del nitrógeno atmosférico por acción bacteriana, eléctrica (relámpagos) y química (industrial) y su liberación a través de la descomposición de materias orgánicas por bacterias o por combustión. Además forma parte del 3% de la composición elemental del cuerpo humano y aparece en los restos de animales. Los científicos han detectado algunos compuestos del espacio exterior que contienen nitrógeno.
2.) PROPIEDADES QUÍMICAS
- Oxígeno:
- Número atómico: 8
- Valencia: 2
- Estado de oxidación: - 2
- Electronegatividad: 3,5
- Radio covalente (Å): 0,73
- Radio iónico (Å): 1,40
- Radio atómico (Å) : -
- Configuración electrónica: 1s22s22p4
- Primer potencial de ionización (eV): 13,70
- Masa atómica (g/mol): 15,9994
- Densidad (kg/m3): 1.429
- Punto de ebullición (ºC): -183
- Punto de fusión (ºC): -218,8
- En la combustión una sustancia química reacciona rápidamente con oxígeno produciendo calor y luz.
- Descubridor: Joseph Priestly 1774
- Nitrógeno:
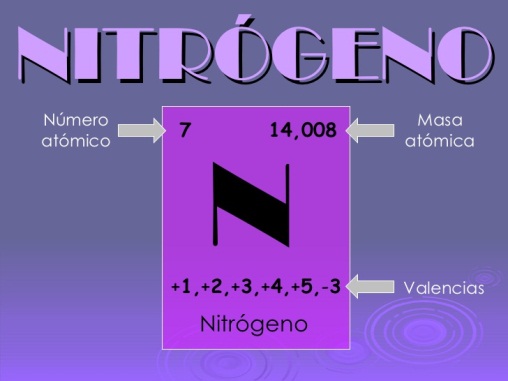
- Número atómico: 7
- Valencia: 1,2,+3,-3,4,5
- Estado de oxidación: - 3
- Electronegatividad: 3,0
- Radio covalente (Å): 0,75
- Radio iónico (Å): 1,71
- Radio atómico (Å): 0,92
- Configuración electrónica: 1s22s22p3
- Primer potencial de ionización (eV): 14,66
- Masa atómica (g/mol): 14,0067
- Densidad (g/ml): 0,81
- Punto de ebullición (ºC): -195,79 ºC
- Punto de fusión (ºC): -218,8
- Descubridor: Rutherford en 1772
3.) PROPIEDADES FÍSICAS
- Oxígeno
En condiciones normales de presión y temperatura (STP), el oxigeno se encuentra en estado gaseoso formando moléculas diatónicas (O2). Al igual que el hidrógeno, no posee propiedades organolépticas, es decir es incoloro, inodoro e insípido.
El oxigeno se condensa a -183oC en un líquido azul pálido. Se solidifica a -219oC en un sólido blando azulado. Para ambos estados de agregación es muy paramagnético, es decir, sus regiones más probables de encontrar electrones u orbitales tienden a alinearse paralelamente cuando están en presencia de un campo magnético.
Si se suministra energía al oxígeno diatómico se obtiene la otra forma alotrópica del oxigeno conocida como ozono, de acuerdo con la reacción siguiente:
3Oo (g) → 2O3 (g)
La estructura de Lewis consideraba para el oxigeno presenta electrones sin pareja que violentan la regla del octeto, pero justifican el carácter paramagnético del oxígeno molecular, de acuerdo al cual el oxígeno es atraído por un campo magnético, tanto en su estado gaseoso como en estado líquido.
El ozono no es magnético, por tanto se le considera una estructura en la cual todos los electrones están apareados.
El ozono tiene un olor fuerte y penetrante. Éste es más soluble en agua que el oxigeno debido a que las moléculas del O3 son polares, sin embargo las del O2 no lo son.
Si llevamos el ozono a una temperatura de -111.5 oC se convierte en un líquido azul intenso de carácter fuertemente explosivo. El ozono es un agente oxidante fuerte. Sus aplicaciones se basan, precisamente, en su fuerte carácter oxidante.
El ozono se usa como germicida, como decolorante de ceras, féculas, grasas y barnices.
El oxigeno tiene tres isótopos estables y diez radiactivos. Los radioisótopos tienen todos una vida media de menos de tres minutos.
- Nitrógeno
Una de las propiedades de los elementos no metales como el nitrógeno es por ejemplo que los elementos no metales son malos conductores del calor y la electricidad. El nitrógeno, al igual que los demás elementos no metales, no tiene lustre. Debido a su fragilidad, los no metales como el nitrógeno, no se pueden aplanar para formar láminas ni estirados para convertirse en hilos.
El oxígeno es un gas s, de densidad 1.1056 en relación con el aire (densidad 0,00143 g/cm³); es incoloro, inodoro e insípido.
Es poco soluble en agua (0.0410 en agua a 0°c ), pero es absorbido en frío mejor que en caliente por algunos metales y ciertos óxidos metálicos como ser la plata fundida, la cual absorbe 22 veces su volumen sin combinación. Cuando la plata se enfría el oxígeno se libera produciendo desgarraduras. El oxígeno licua a una temperatura de -139 °c a una presión de 22.5 atm. y es de un color azulado el cual hierve a -182,5°c. El calor de disociación del oxígeno molecular es de -117.3 Kcal/mol.
El oxígeno se encuentra en dos variedades alotrópicas O2 y O3. También existe el O4 el cual aumenta en proporción con el descenso de la temperatura.
El estado del nitrógeno en su forma natural es gaseoso.
El nitrógeno es un elmento químico de aspecto incoloro y pertenece al grupo de los no metales.
El número atómico del nitrógeno es 7.
El símbolo químico del nitrógeno es N.
El punto de fusión del nitrógeno es de 63,14 grados Kelvin o de -209,01 grados celsius o grados centígrados.
El punto de ebullición del nitrógeno es de 77,35 grados Kelvin o de -194,8 grados celsius o grados centígrados.
4.) OBTENCIÓN
- Oxígeno
El oxígeno industrialmente se puedo obtener a partir de la destilación fraccionada del aire líquido. En este procedimiento llamado método de Georges Claude se desprende primero ázoe a -193° y luego el oxígeno a -181°.
- Nitrógeno
a) a partir del aire.
El nitrógeno puede obtenerse del aire por simple eliminación del oxígeno. En el laboratorio, haciendo pasar el aire arriba de cobre calentado, éste se apodera del oxígeno para formar óxido cúprico sólido, CuO. Si se quema fósforo en una campana invertida sobre agua se forma fósforo pentaoxidado sólido, que se disuelve en el agua y deja un residuo que en su mayor parte es nitrógeno. Otro método de obtención consiste en hacer burbujear aire en una solución alcalina de pirogalol, que absorbe al oxígeno.
En la industria el nitrógeno se obtiene a partir del aire líquido.
b) a partir de sus compuestos.
El nitrógeno puede prepararse por oxidación del amoníaco, por lo cual se hace pasar este gas sobre óxido de cobre calentado al rojo.
2NH3 + 3CuO flecha 3H2O + N2 + 3Cu0
Un método más conveniente consiste en la descomposición del nitrito de amonio, NH4NO2. Este compuesto es inestable, y se descompone y se descompone fácilmente en agua y da nitrógeno. Cuando se calienta suavemente una disolución que contiene una mezcla de cloruro de amonio y nitrito de sodio, se desprende nitrógeno.
NH4+ + NO2 flecha 2H2O + N2.
5.) APLICACIÓN
- Oxigeno
Las principales aplicaciones del oxígeno en orden de importancia son: 1) fundición, refinación y fabricación de acero y otros metales; 2) manufactura de productos químicos por oxidación controlada; 3) propulsión de cohetes; 4) apoyo a la vida biológica y medicina, y 5) minería, producción y fabricación de productos de piedra y vidrio.
La principal utilización del oxígeno, se usa oxígeno líquido en los motores de propulsión de los cohetes, mientras que en los procesos industriales y en el transporte el oxígeno para la combustión se toma directamente del aire. Otras aplicaciones industriales son la soldadura y la fabricación de acero y metanol.
La medicina también hace uso del oxígeno suministrándolo como suplemento a pacientes con dificultades respiratorias; y se emplean botellas de oxígeno en diversas prácticas deportivas como el submarinismo o laborales, en el caso de acceder a lugares cerrados, o escasamente ventilados, con atmósferas contaminadas (limpieza interior de depósitos, trabajo en salas de pintura, etc.)
- Nitrógeno
La aplicación comercial más importante del nitrógeno diatómico es la obtención de amoníaco por el proceso de Haber. El amoníaco se emplea con posterioridad en la fabricación de fertilizantes y ácido nítrico.
Las sales del ácido nítrico incluyen importantes compuestos como el nitrato de potasio (nitro o salitre empleado en la fabricación de pólvora) y el nitrato de amonio fertilizante.
Los compuestos orgánicos de nitrógeno como la nitroglicerina y el trinitrotolueno son a menudo explosivos. La hidracina y sus derivados se usan como combustible en cohetes.
El ciclo de este elemento es bastante más complejo que el del carbono, dado que está presente en la atmósfera no solo como N2 (78 %) sino también en una gran diversidad de compuestos. Se puede encontrar principalmente como N2O, NO y NO2, los llamados NOx. También forma otras combinaciones con oxígeno tales como N2O3 y N2O5 (anhídridos), "precursores" de los ácidos nitroso y nítrico. Con hidrógeno forma amoníaco (NH3), compuesto gaseoso en condiciones normales.
Al ser un gas poco reactivo, el nitrógeno se emplea industrialmente para crear atmósferas protectoras y como gas criogénico para obtener temperaturas del orden de 78K de forma sencilla y económica. Inclusive se utiliza para inflar los neumáticos en los trenes de aterrizaje de los aviones, evitando condensación de agua a grandes alturas o su combustión al aterrizar.
6.) MÁS SOBRE ELLOS
OXÍGENO
- Características
-Estructura
En condiciones normales de presión y temperatura, el oxígeno es un gas incoloro e inodoro con fórmula molecular O2, en el que dos átomos de oxígeno se enlazan con una configuración electrónica en estado triplete. Este enlace tiene un orden de enlace de dos y se suele simplificar en las descripciones como un enlace doble o como una combinación de un enlace de dos electrones y dos enlaces de tres electrones.
El oxígeno triplete —no debe confundirse con el ozono, O3— es el estado fundamental de la molécula O2,11 que cuenta con dos electrones desparejados que ocupan dos orbitales moleculares degenerados.nota 1 Estos orbitales se clasifican como antienlaces —debilitan el orden de enlace de tres a dos—, de manera que el enlace del dioxígeno es más débil que el triple enlace del nitrógeno diatómico, en el que todos los orbitales de los enlaces moleculares se rellenan, pero algunos orbitales de antienlace no lo están.
En su forma normal de triplete, las moléculas de O2 son paramagnéticas; es decir, que en presencia de un campo magnético forman un imán, debido al momento magnético del espín de los electrones desparejados en la molécula y la interacción de canje negativa entre moléculas de O2 contiguas. Un imán atrae al oxígeno líquido hasta tal punto que, en demostraciones de laboratorio, un hilo de oxígeno líquido puede sostenerse contra su propio peso entre los polos de un imán potente.
El oxígeno molecular singlete es un nombre dado a varias especies de O2 de mayor energía, en las que todos los espínes de los electrones se emparejan. Es mucho más reactivo con moléculas orgánicas habituales que el oxígeno molecular en sí mismo. En la naturaleza, el oxígeno singlete se suele formar con el agua en la fotosíntesis, usando la energía solar. También se produce en la troposfera a causa de la fotolisis del ozono por la luz de onda corta así como por el sistema inmunitario como una fuente de oxígeno activo. En los organismos fotosintéticos —y posiblemente también en los animales—, los carotenoides juegan un papel fundamental en la absorción de energía del oxígeno singlete y la conversión de este a su estado no excitado antes de que pueda causar daño a los tejidos.
-Abundancia
El oxígeno es el elemento químico más abundante, por masa, en la biosfera, el aire, el mar y el suelo terrestres. Es, asimismo, el tercero más abundante en el universo, tras el hidrógeno y el helio. Alrededor del 0,9 % de la masa del Sol es oxígeno, que constituye también el 49,2 % de la masa de la corteza terrestre y es el principal componente de los océanos de la Tierra (88,8 % de su masa total). El oxígeno gaseoso es el segundo componente más abundante en la atmósfera terrestre, ya que supone un 20,8 % de su volumen y el 23,1 % de su masa (unas 1015 toneladas).
La Tierra es una excepción entre los planetas del Sistema Solar por la alta concentración de oxígeno gaseoso en su atmósfera; por ejemplo, Marte (con un 0,1 % de O2 del total de su volumen) y Venus tienen concentraciones mucho menores. Sin embargo, el O2 que rodea a estos planetas proviene exclusivamente de la reacción que sufren moléculas que contienen oxígeno, como el dióxido de carbono, por efecto de la radiación ultravioleta.
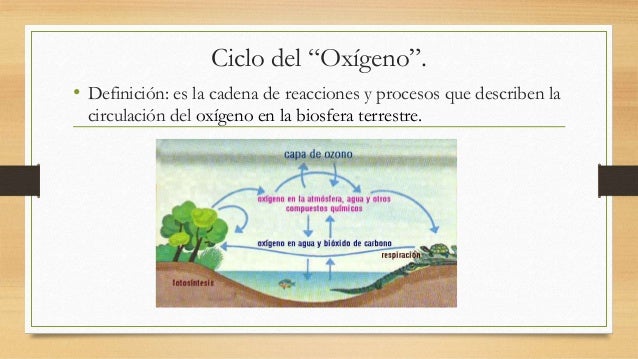
La inusualmente alta concentración de oxígeno gaseoso en la Tierra es el resultado del ciclo de circulación. Este ciclo biogeoquímico describe el movimiento del oxígeno en el interior de sus tres principales reservas en el planeta: la atmósfera, la biosfera y la litosfera. El factor de conducción más importante en este ciclo es la fotosíntesis, responsable de la atmósfera moderna de la Tierra, que libera oxígeno en la atmósfera, mientras que los procesos de respiración y descomposición lo eliminan. En el equilibrio actual, la producción y el consumo tienen lugar con un ratio aproximado de 1/2000 de la totalidad del oxígeno atmosférico por año.
La nebulosa Ojo de Gato tiene regiones ricas en oxígeno ionizado, mostrado de color verde en la imagen.
- Rol biológico
-Fotosíntesis y respiración
El oxígeno es liberado por las bacterias fotosintéticas, las algas y las plantas mediante la fotosíntesis. En el proceso inverso los organismos aerobios, mediante la respiración, usan el oxígeno para convertir los nutrientes en energía (ATP). La disminución de oxígeno provoca hipoxemia y su falta total, anoxia, lo que puede provocar la muerte del organismo.
En la naturaleza el oxígeno no combinado se produce por la fotodescomposición del agua durante la fotosíntesis. Según algunas estimaciones, las algas verdes y las cianobacterias de ambientes marinos proporcionan alrededor del 70 % del producido en la Tierra, y las plantas terrestres, el resto. Unos investigadores estiman que la contribución oceánica al oxígeno atmosférico es aún mayor, mientras que otros la sitúan por debajo, en torno a un 45 % del oxígeno atmosférico total del planeta cada año.
Una fórmula global simplificada de la fotosíntesis es:
6 CO2 + 6 H2O + fotones → C6H12O6 + 6 O2
dióxido de carbono + agua + luz solar → glucosa + dioxígeno
La evolución fotolítica del oxígeno tiene lugar en las membranas tilacoides de los organismos fotosintéticos y requiere la energía de cuatro fotones. Están implicados muchos procesos, pero el resultado es la formación de un gradiente de un protón a través de la membrana tilacoide, que se usa para sintetizar adenosín trifosfato (ATP) por la fotofosforilación. El O2 restante tras la oxidación de la molécula de agua se libera a la atmósfera.
El dioxígeno molecular es esencial para la respiración celular en todos los organismos aerobios, ya que las mitocondrias lo usan para ayudar a generar adenosín trifosfato durante la fosforilación oxidativa. La reacción para la respiración aerobia es básicamente lo contrario que la fotosíntesis y se simplifica de la siguiente forma:
C6H12O6 + 6 O2 → 6 CO2 + 6 H2O + 2880 kJ•mol−1
En los vertebrados el O2 se difunde por membranas pulmonares hacia los glóbulos rojos. La hemoglobina envuelve el O2 y hace que cambie su color de un rojo azulado a un rojo brillante (el CO2 se libera desde otra parte de la hemoglobina mediante el efecto Bohr). Otros animales usan la hemocianina (moluscos y algunos artrópodos) o la hemeritrina (arañas y langostas). Un litro de sangre puede disolver 200 cm³ de O2.
Las especies reactivas de oxígeno, como el ion superóxido (O2-) y el peróxido de hidrógeno, son peligrosos subproductos del uso de oxígeno en los organismos.38 Algunas partes del sistema inmunitario de organismos más avanzados, sin embargo, crean peróxido, superóxido y oxígeno singlete para destruir microbios invasores. Las especies reactivas de oxígeno también tienen un rol importante en la respuesta hipersensible de las plantas contra ataques patógenos.
Un adulto humano en reposo respira de 1,8 a 2,4 gramos de oxígeno por minuto. Sumada la cantidad inhalada por todas las personas del planeta, hace un total de 6000 millones de toneladas de oxígeno por año.
-Contenido en el cuerpo
El contenido de oxígeno en el cuerpo de un ser vivo es normalmente mayor en el sistema respiratorio y disminuye a lo largo de cualquier sistema arterial, los tejidos periféricos y el sistema venoso, respectivamente. El contenido de oxígeno en este sentido se suele dar como la presión parcial, que es la presión que tendría el oxígeno si ocupase por sí solo el volumen de las venas.
- Combustión y otros riesgos
Las fuentes de oxígeno que están altamente concentradas estimulan una rápida combustión. Los riesgos de fuego y explosión se dan cuando los oxidantes concentrados y los combustibles se sitúan demasiado cerca entre sí; sin embargo, la ignición, ya sea por el calor o por una chispa, es necesaria para iniciar la combustión.109 El oxígeno en sí mismo no es un combustible, sino un oxidante. Los riesgos de la combustión también se aplican a compuestos de oxígeno de alto potencial oxidante, como los peróxidos, cloratos, nitratos, percloratos y dicromatos, porque pueden dar oxígeno al fuego.
El O2 concentrado permite una combustión rápida y enérgica. Las tuberías y los recipientes de acero usados para almacenar y trasmitir tanto el oxígeno líquido como el gaseoso actúan como combustible; por tanto, el diseño y la fabricación de los sistemas de O2 requieren una atención especial para asegurar que las fuentes de ignición se minimizan. El incendio que acabó con la vida de la tripulación del Apolo 1 en una prueba en la plataforma de lanzamiento se extendió tan rápidamente debido a que la cápsula estaba presurizada con O2 puro, pero a una presión ligeramente mayor que la atmosférica, en lugar de una presión de 1/3 de la normal que debía usarse en la misión.
En caso de un derrame de oxígeno líquido, si este llega a empaparse en materia orgánica como madera, productos petroquímicos y asfalto puede provocar que estos materiales detonen de forma impredecible al sufrir un impacto mecánico posterior. Al igual que otros líquidos criogénicos, en contacto con el cuerpo humano puede causar congelamiento en piel y ojos.
El interior del módulo de mando del Apolo 1. El O2 puro a una presión mayor de lo normal y una chispa produjeron un incendio y la consiguiente pérdida de la tripulación.
NITRÓGENO
- Compuestos
Con el hidrógeno forma el amoníaco (NH3), los nitritos (NO2), los nitratos (NO3), los ácidos nítricos (HNO3), la hidracina (N2H4) y el aziduro de hidrógeno (N3H, también conocido como azida de hidrógeno o ácido hidrazoico). El amoníaco líquido, anfótero como el agua, actúa como una base en una disolución acuosa, formando iones amonio (NH4+), y se comporta como un ácido en ausencia de agua, cediendo un protón a una base y dando lugar al anión amida (NH2). Se conocen largas cadenas y compuestos cíclicos de nitrógeno, pero son muy inestables.
Con los halógenos forma: NF3, NF2Cl, NFCl2, NCl3, NBr3.6 NH3, NI3.6 NH3, N2F4, N2F2 (cis y trans), N3F, N3Cl, N3Br y N3I.
Con el oxígeno forma varios óxidos que ya hemos nombrado: el nitroso o gas de la risa, el nítrico y el dióxido de nitrógeno. Son producto de procesos de combustión contribuyendo a la aparición de episodios contaminantes de smog fotoquímico. Otros óxidos son el trióxido de dinitrógeno (N2O3) y el pentóxido de dinitrógeno (N2O5), ambos muy inestables y explosivos.
- Importancia biológica
El nitrógeno es un componente esencial de los aminoácidos y los ácidos nucleicos, vitales para los seres vivos. De todos los nutrientes minerales, el nitrógeno es el que mayor efecto tiene en el crecimiento de las plantas y, por lo tanto, en la productividad primaria de los ecosistemas, lo que afecta a su vez a todos los organismos que dependen de ellas: el aumento en el rendimiento de las cosechas a partir de que se comenzaron a utilizar fertilizantes nitrogenados en el siglo XIX lo demuestra. A pesar de la gran cantidad de nitrógeno atmosférico, este elemento es limitante: pocos organismos pueden asimilarlo en esta forma. Las plantas solamente pueden asimilarlo eficientemente forma de iones amonio (NH4+) o nitrato (NO3-), aunque también pueden absorber pequeñas cantidades de aminoácidos y urea.
Algunas plantas han establecido relaciones simbióticas con hongos y procationtes capaces de reducir el nitrógeno atmosférico a amonio, a cambio de lo cual reciben moléculas energéticas de la planta hospedera. El nitrógeno reducido es así incorporado a la cadena trófica (véase también el ciclo del nitrógeno). Quizás el caso más conocido sea el de las bacterias del género Rhizobium con las leguminosas, pero también existen asociaciones con bacterias del género Frankia e inclusive algunas cianobacterias. Finalmente, también algunos hongos, llamados ectomicorrízicos, extienden sus filamentos más allá del alcance de las raíces, formando micorrizas que hacen más eficiente la absorción de nitritos, nitratos y amoniodel suelo en ambientes limitantes.
- Isótopos
Existen dos isótopos estables del nitrógeno, N-14 y N-15, siendo el primero —que se produce en el ciclo carbono-nitrógeno de las estrellas— el más común sin lugar a dudas (99,634 %). De los diez isótopos que se han sintetizado, uno tiene un periodo de semidesintegración de nueve minutos (el N-13), y el resto de segundos o menos.
Las reacciones biológicas de nitrificación y desnitrificación influyen de manera determinante en la dinámica del nitrógeno en el suelo, casi siempre produciendo un enriquecimiento en N-15 del sustrato.
- Precauciones
Los fertilizantes nitrogenados son una importante fuente de contaminación del suelo y de las aguas. Los compuestos que contienen iones de cianuro forman sales extremadamente tóxicas y son mortales para numerosos animales, entre ellos los mamíferos.
-Efectos del nitrógeno sobre la salud
Las moléculas de nitrógeno, en estado natural, se encuentran principalmente en el aire. En el agua y en los suelos el nitrógeno puede ser encontrado compuesto, en forma de nitratos y nitritos.
Los humanos han cambiado radicalmente las proporciones naturales de nitratos y nitritos, mayormente debido a la aplicación de estiércoles que contienen nitrato. El nitrógeno es emitido en grandes cantidades por las industrias. A lo largo de la historia, se nota un incremento de la presencia de nitratos y nitritos en el suelo y en el agua como consecuencia de reacciones que tienen lugar en el ciclo del nitrógeno. Esto se refleja en un incremento de la concentración de nitrógeno en las fuentes utilizadas para consumo humano, y por ende también en el agua potable.
Los nitratos y nitritos son conocidos por causar varios efectos sobre la salud humana. Estos son los efectos más comunes:
Tiene reacciones con la hemoglobina en la sangre, causando una disminución en la capacidad de transporte de oxígeno por la sangre. (nitrito)
Provoca la disminución del funcionamiento de la glándula tiroidea. (nitrato)
Ocasiona un bajo almacenamiento de la vitamina A. (nitrato)
Favorece la producción de nitrosaminas, las cuales son conocidas como una de las causas más comunes de cáncer. (nitratos y nitritos)
Desde un punto de vista metabólico, el óxido de nitrógeno (NO) es mucho más importante que el nitrógeno. En 1987, Salvador Moncada descubrió que éste era un mensajero vital del cuerpo para la relajación de los músculos, y hoy se sabe que está involucrado en el sistema cardiovascular, el sistema inmunitario, el sistema nervioso central y el sistema nervioso periférico. La enzima que produce el óxido nítrico, la óxido-nítrico sintasa, es abundante en el cerebro.
Aunque el óxido nítrico tiene una vida relativamente corta, se puede difundir a través de las membranas para llevar a cabo sus funciones. En 1991, un equipo encabezado por K.-E. Anderson del hospital universitario de Lund, Suecia, demostró que el óxido nítrico activa la erección por medio de la relajación del músculo que controla el flujo de sangre en el pene. La droga Viagra trabaja liberando óxido nítrico para producir el mismo efecto.
- Abundancia y obtención
El nitrógeno es el componente principal de la atmósfera terrestre (78,1 % en volumen) y se obtiene para usos industriales de la destilación del aire líquido. Está presente también en los restos de animales, por ejemplo el guano, usualmente en la forma de urea, ácido úrico y compuestos de ambos. Por deficiencia causa falta de relajación de los músculos, problemas en el sistema cardiovascular, en el nervioso central y periférico.
También ocupa el 3 % de la composición elemental del cuerpo humano.
Se han observado compuestos que contienen nitrógeno en el espacio exterior y el isótopo Nitrógeno-14 se crea en los procesos de fusión nuclear de las estrellas. Se obtiene de Haizea
CONCLUSIONES
- El oxigeno es muy importante para la vida y se divide en distintas etapas las cuales conforman el ciclo del oxigeno.
- También recordemos que el oxigeno es un componente muy importante el aire ya que gracias al él se es posible la vida.
- Su descubrimiento gracias a químicos que hicieron procesos para descubrirlo, marcó historia en esa época.
- Nos hemos dado cuenta que no solo los humanos dependemos de él, sino que también los animales, las plantas, entre otras cosas, así como procesos para hacer ciertos objetos y las industrias.
- El nitrógeno como gas no toxico es muy útil en la industria en nuestro caso la industria farmacéutica en la desinfección, conservación y tratamiento de envases y recipientes para el uso de productos farmacéuticos.
- Como pudimos observar el nitrógeno también está presente en nuestro cuerpo humano y cumpliendo funciones importantes, el nitrógeno hace parte del ADN que es el que contiene la información genetica y se presenta como bases nitrogenadas que son la timina, adenina, guanina y citosina.
- El consumo de nitrógeno es fundamental para el buen funcionamiento del sistema humano puesto que el Nitrógeno (N) junto a otros elementos, como Carbono, Oxigeno e Hidrogeno participan en la constitución de las moléculas orgánicas fundamentales de la materia viva por lo cual es importante consumir productos ricos en nitrógeno tales como carnes, huevos y leche
WEBGRAFÍA
- https://www.enciclopediadetareas.net/2011/04/propiedades-fisicas-del-oxigeno.html
- http://literaturaquimicaelnitrogeno.blogspot.com/2015/04/propiedades-fisicas-del-nitrogeno.html
-https://www.investigacionyciencia.es/blogs/fisica-y-quimica/10/posts/la-combustin-y-el-oxigeno-10170
- https://www.textoscientificos.com/quimica/oxigeno
- https://www.textoscientificos.com/quimica/nitrogeno
- https://es.answers.yahoo.com/question/index?qid=20081204171144AAJCf7F
- http://www10.uniovi.es/semanacyt2009/experimentando/nitrogeno/aplicaciones.html
- https://es.wikipedia.org/wiki/Ox%C3%ADgeno#Caracter%C3%ADsticas
- https://es.wikipedia.org/wiki/Nitr%C3%B3geno#Compuestos
- http://literaturaquimicaelnitrogeno.blogspot.com/2015/04/propiedades-fisicas-del-nitrogeno.html
-https://www.investigacionyciencia.es/blogs/fisica-y-quimica/10/posts/la-combustin-y-el-oxigeno-10170
- https://www.textoscientificos.com/quimica/oxigeno
- https://www.textoscientificos.com/quimica/nitrogeno
- https://es.answers.yahoo.com/question/index?qid=20081204171144AAJCf7F
- http://www10.uniovi.es/semanacyt2009/experimentando/nitrogeno/aplicaciones.html
- https://es.wikipedia.org/wiki/Ox%C3%ADgeno#Caracter%C3%ADsticas
- https://es.wikipedia.org/wiki/Nitr%C3%B3geno#Compuestos















EN INFORME DE GASES FALTO MARCO TEORICO 4.5
ResponderEliminar