REACCIONES Y ECUACIONES QUÍMICAS
INTRODUCCIÓN
En el presente trabajo se definirán términos como reacción química y ecuación química, para conocer mas sobre los temas, también se identificarán las clases de reacciones, además de como escribir ecuaciones adecuadamente y sus requisitos.
OBJETIVOS
- Definir los términos básicos para tener una mejor comprensión a la hora de escribir una ecuación
- Reconocer las clases de reacciones, tanto las inorgánicas como las orgánicas y la clasificación de estas según sus criterios
- Reconocer las clases de reacciones, tanto las inorgánicas como las orgánicas y la clasificación de estas según sus criterios
- Entender como escribir una ecuación correctamente
- Identificar los requisitos que una ecuación debe tener
REACCIÓN QUÍMICAS
Una reacción química, también llamada cambio químico o fenómeno químico, es todo proceso termodinámico en el cual dos o más sustancias (llamadas reactantes o reactivos), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.
CLASES DE REACCIONES
* Reacciones de la química inorgánica:
Desde un punto de vista de la química inorgánica se pueden postular dos grandes modelos para las reacciones químicas de los compuestos inorgánicos: reacciones ácido-base o de neutralización (sin cambios en los estados de oxidación) y reacciones redox (con cambios en los estados de oxidación). Sin embargo podemos clasificarlas de acuerdo con los siguientes tres criterios:
- De síntesis o de combinación: Donde los reactivos se combinan entre sí para originar un producto diferente.
A + B → C (siendo A y B reactivos cualesquiera y C el producto formado)
A + B → C (siendo A y B reactivos cualesquiera y C el producto formado)
- Ejemplo: 2 Na (s) + Cl2 (g) → 2 NaCl (s)
- De Descomposición:
- Descomposición simple: Una sustancia compuesta se desdobla en sus componentes
A → B + C (inversa de la síntesis, y A es un compuesto que se descompone en los reactivos que lo componen, B y C.)
-Ejemplo: CO2 (g) → CO2 (g) C(s) + O2 (g)
- Mediante un reactivo: Una sustancia requiere un reactivo, para su descomposición.
AB + C → AC + BC (el compuesto AB reacciona con el reactivo C, para originar los compuestos AC y BC)
-Ejemplo: 2 ZnS (S) + 3 O2 (g) → 2 ZnO (S) + 2 SO2 (g)
- De sustitución o desplazamiento: Una sustancia sustituye el lugar de alguno de los componentes de los reactivos, de tal manera que el componente sustituido queda libre.
AB +C → AC + B (donde el compuesto AB reacciona con el reactivo C para formar el compuesto AC y liberar B)
- Ejemplo: Pb (NO3)2 (ac) + 2 KI (ac) → Pbl2 (s) + 2 KNO3 (ac)
- De doble sustitución (o de doble desplazamiento): Se presenta un intercambio entre los elementos químicos o grupos de elementos químicos de las sustancias que intervienen en la reacción química.
AB + CD → AC + BD
- Ejemplo: Pb (NO3)2 (ac) + 2 KI (ac) → Pbl2 (s) + 2 KNO3 (ac)
- Reacciones inorgánicas según la energía intercambiada -
- Intercambio en forma de calor:
-Reacciones exotérmicas: que desprenden calor del sistema de reacción
- Ejemplo: Combustión
- Reacciones endotérmicas: reacciones en las que se absorbe o se requiere calor para llevarse a cabo.
- Ejemplo: Calcinación
- Intercambio en forma de luz:
- Reacciones endoluminosas: que requieren el aporte de energía luminosa o luz al sistema para llevarse a cabo.
- Ejemplo: Fotosíntesis
- Reacciones exoluminosas: reacciones que al llevarse a cabo manifiestan una emisión luminosa
- Ejemplo: Combustión del magnesio: 2Mg+O2 + ΔH → 2MgO + Luz
- Intercambio en forma de energía eléctrica:
- Reacciones endoeléctricas: que requieren el aporte de energía eléctrica para que puedan tener lugar.
- Ejemplo: Electrólisis del agua
- Reacciones exoeléctricas: aquellas reacciones químicas en las que el sistema transfiere al exterior energía eléctrica.
- Ejemplo: Celda galvánica (pila o batería eléctrica)
* Reacciones de la química orgánica:
Respecto a las reacciones de la química orgánica, nos referimos a ellas teniendo como base a diferentes tipos de compuestos como alcanos, alquenos, alquinos, alcoholes, aldehídos, cetonas, entre otras; que encuentran su clasificación, reactividad y/o propiedades químicas en el grupo funcional que contienen y este último será el responsable de los cambios en la estructura y composición de la materia. Entre los grupos funcionales más importantes tenemos a los dobles y triples enlaces y a los grupos hidroxilo, carbonilo y nitro.
- Reacciones orgánicas por su mecanismo -
* Reacciones de adición: incluye reacciones tales como la halogenación, hidrohalogenación e hidratación.
- Adición electrofílica: es una reacción de adición donde en un compuesto químico, el sustrato de la reacción, se pierde un enlace pi para permitir la formación de dos nuevos enlaces sigma. En las reacciones de adición electrofílica, los sustratos más comunes tienen enlaces dobles o enlaces triples carbono-carbono.
- Adición nucleofílica: es una reacción de adición donde en un compuesto químico un enlace π es eliminado mediante la adición de un nucleófilo, creándose dos nuevos enlaces covalentes (uno en cada extremo de lo que era el enlace múltiple).
- Adición radicalaria: es cualquier reacción química que involucra a radicales libres. Este tipo de reacción es abundante en reacciones orgánicas.
* Reacción de eliminación: incluye procesos tales como la deshidratación, y se observa que siguen mecanismos de reacción E1, E2, o E1cB
* Reacciones de sustitución: con mecanismos de reacción SN1, SN2 y SNi
- sustitución nucleofílica alifática: es un tipo de reacción de sustitución en la que un nucleófilo, "rico en electrones", reemplaza en una posición electrófila, "pobre en electrones", de una molécula a un átomo o grupo, denominados grupo saliente.
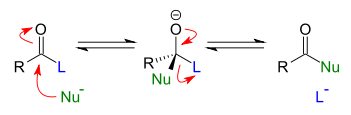
- sustitución nucleofílica acílica: consiste en una reacción de sustitución nucleófila sobre la posición carbonílica de un compuesto acílico por parte de un nucleófilo. Los compuestos acílicos son derivados del ácido carboxílico, lo que incluye ésteres, amidas, anhídridos carboxílicos y haluros de acilo.
- sustitución nucleofílica aromática: es un tipo de reacción de sustitución nucleófila en la que el nucleófilo desplaza a un buen grupo saliente, como un haluro, en un anillo aromático. Esto ocurre fácilmente cuando en las posiciones orto y para hay grupos tractores de Densidad electrónica fuertes con respecto al haluro.
- sustitución electrofílica aromática: es una reacción perteneciente a la química orgánica, en el curso de la cual un átomo, normalmente hidrógeno, unido a un sistema aromático es sustituido por un grupo electrófilo. Esta es una reacción muy importante en química orgánica, tanto dentro de la industria como a nivel de laboratorio.
- sustitución radicalaria: es una reacción de sustitución que involucra radicales libres como un intermediario de reacción.
La reacción siempre involucra dos pasos como mínimo, y posiblemente un tercero.
* Reacciones orgánicas redox: son reacciones redox específicas de los compuestos orgánicos y son muy comunes.
* Reacciones de transposición:
- Transposiciones 1,2: es un tipo de reacción orgánica donde un sustituyente se desplaza de un átomo a otro dentro de un compuesto químico. En una transposición 1,2 el movimiento implica a dos átomos adyacentes, pero es posible observar desplazamientos sobre distancias mayores.
- Reacciones pericíclicas: es una reacción concertada en la que el estado de transición tiene una geometría cíclica. Las reacciones pericíclicas suelen ser reacciones de rearreglo.
- Metátesis: se refiere al intercambio de átomos entre dos moléculas. En la química de alquenos, metátesis es el intercambio de átomos de carbono entre un par de olefinas para producir dos olefinas con los sustituyentes intercambiados. Es un proceso intra o intermolecular entre 2 olefinas (también posible entre 2 alquinos o una olefina y un alquino) que da lugar a un intercambio entre las dos unidades del alqueno.
ECUACIÓN QUÍMICA
Una ecuación química es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (llamadas reactivos ) y las sustancias que se originan (llamadas productos). La ecuación química ayuda a visualizar los reactivos que son los que tendrán una reacción química y los productos, que son las sustancias que se obtienen de este proceso. Además se pueden ubicar los símbolos químicos de cada uno de los elementos o compuestos que estén dentro de la ecuación y poder balancearlos con mayor facilidad.
* Requisitos para una ecuación química:
Una ecuación química debe:
- Cumplir con la ley de conservación de la materia.
En un sistema aislado, durante toda reacción química ordinaria, la masa total en el sistema permanece constante, es decir, la masa consumida de los reactivos es igual a la masa de los productos obtenidos
- Cumplir con la ley de conservación de la carga.
establece que no hay destrucción ni creación neta de carga eléctrica, y afirma que en todo proceso electromagnético la carga total de un sistema aislado se conserva.
- Cumplir con la ley de conservación de la energía.
afirma que la cantidad total de energía en cualquier sistema físico aislado (sin interacción con ningún otro sistema) permanece invariable con el tiempo, aunque dicha energía puede transformarse en otra forma de energía. En resumen, la ley de la conservación de la energía afirma que la energía no puede crearse ni destruirse, solo puede cambiar de una forma a otra, por ejemplo, cuando la energía eléctrica se transforma en energía calorífica en un calefactor.
- Corresponder a un proceso real.
COMO SE ESCRIBE UNA ECUACIÓN
1. Los reactivos se separan de los productos con una flecha (  ) que indica el sentido de la reacción. Una flecha doble (
) que indica el sentido de la reacción. Una flecha doble ( ) indica que la reacción se efectúa en ambas direcciones y establece un equilibrio entre los reactivos y los productos.
) indica que la reacción se efectúa en ambas direcciones y establece un equilibrio entre los reactivos y los productos.
2. Los reactivos se colocan a la izquierda y los productos a la derecha de la flecha. Un signo ( + ) se coloca entre cada reactivo y entre cada producto, cuando es necesario.
3. Las condiciones necesarias para efectuar la reacción pueden, si se desea, colocarse arriba o abajo de la flecha o signo de igualdad. Por ejemplo, una letra delta mayúscula
( ) colocada sobre la flecha (
) colocada sobre la flecha ( ) indica que se suministra calor a la reacción.
) indica que se suministra calor a la reacción.
4. Se colocan coeficientes (números enteros) frente a los símbolos de las sustancias (por ejemplo, 2 H2O) para equilibrar o balancear la ecuación e indicar el número de unidades fórmula (átomos, moléculas, moles, iones) de cada sustancia que reacciona o que se produce. Cuando no se indica número alguno, se sobrentiende que se trata de una unidad fórmula.
5. El estado físico de la sustancias se indica mediante los siguientes símbolos: ( s ) para el estado sólido; ( l ) para el estado líquido; ( g )para el estado gaseoso; y ( ac ) para las sustancias en solución acuosa.
6. Empiece con las partes más complejas, es decir con los compuestos que tienen varios elementos. En algunos casos, simplemente consiste en ajustar primero los átomos diferentes al hidrógeno y al oxígeno.
7. Ajuste el hidrógeno y el oxígeno agregando agua si es necesario, después de que todos los otros elementos estén balanceados.
8. Deje los elementos en estado libre hasta el último momento, ya que cambiando los coeficientes de estos sólo cambian esta clase de átomos. Por ejemplo, cuando se escribe un 2 delante del H2O, se duplica el número de átomos de hidrógeno y oxígeno, pero cuando se escribe un 2 delante del Al sólo cambia el número de átomos de Al.
9. Para reacciones con iones poliatómicos, ajuste el ion como grupo. Por ejemplo, el SO4-2 se ajusta como ion sulfato y no como átomos de S y átomos de O.
10. Generalmente, si aparecen fracciones en la ecuación, se multiplica todo por el número más pequeño que elimine esta fracción. No es esencial hacer desaparecer las fracciones, sin embargo, es más simple en la mayoría de los casos. Además asegúrese al final, que todos los coeficientes estén en relación o proporción más baja posible; si no es el caso, simplifique.
- Considere el siguiente ejemplo:
- Empezando por el fosfato de magnesio (la parte más compleja) y considerando el fosfato de magnesio como grupo, escribimos un 2 delante del H3PO4 para ajustar el grupo fosfato y un 3 delante de Mg(OH)2 para ajustar el Mg dando como resultado:
- Únicamente nos queda el hidrógeno y el oxígeno. Observando el hidrógeno, hay 12 átomos en la izquierda y por tanto necesitamos escribir un 6 delante del H2O. De igual forma se ajustan también los átomos de O que son en total 14. Esto da finalmente:
2. Los reactivos se colocan a la izquierda y los productos a la derecha de la flecha. Un signo ( + ) se coloca entre cada reactivo y entre cada producto, cuando es necesario.
3. Las condiciones necesarias para efectuar la reacción pueden, si se desea, colocarse arriba o abajo de la flecha o signo de igualdad. Por ejemplo, una letra delta mayúscula
(
4. Se colocan coeficientes (números enteros) frente a los símbolos de las sustancias (por ejemplo, 2 H2O) para equilibrar o balancear la ecuación e indicar el número de unidades fórmula (átomos, moléculas, moles, iones) de cada sustancia que reacciona o que se produce. Cuando no se indica número alguno, se sobrentiende que se trata de una unidad fórmula.
5. El estado físico de la sustancias se indica mediante los siguientes símbolos: ( s ) para el estado sólido; ( l ) para el estado líquido; ( g )para el estado gaseoso; y ( ac ) para las sustancias en solución acuosa.
6. Empiece con las partes más complejas, es decir con los compuestos que tienen varios elementos. En algunos casos, simplemente consiste en ajustar primero los átomos diferentes al hidrógeno y al oxígeno.
7. Ajuste el hidrógeno y el oxígeno agregando agua si es necesario, después de que todos los otros elementos estén balanceados.
8. Deje los elementos en estado libre hasta el último momento, ya que cambiando los coeficientes de estos sólo cambian esta clase de átomos. Por ejemplo, cuando se escribe un 2 delante del H2O, se duplica el número de átomos de hidrógeno y oxígeno, pero cuando se escribe un 2 delante del Al sólo cambia el número de átomos de Al.
9. Para reacciones con iones poliatómicos, ajuste el ion como grupo. Por ejemplo, el SO4-2 se ajusta como ion sulfato y no como átomos de S y átomos de O.
10. Generalmente, si aparecen fracciones en la ecuación, se multiplica todo por el número más pequeño que elimine esta fracción. No es esencial hacer desaparecer las fracciones, sin embargo, es más simple en la mayoría de los casos. Además asegúrese al final, que todos los coeficientes estén en relación o proporción más baja posible; si no es el caso, simplifique.
- Considere el siguiente ejemplo:
- Empezando por el fosfato de magnesio (la parte más compleja) y considerando el fosfato de magnesio como grupo, escribimos un 2 delante del H3PO4 para ajustar el grupo fosfato y un 3 delante de Mg(OH)2 para ajustar el Mg dando como resultado:
- Únicamente nos queda el hidrógeno y el oxígeno. Observando el hidrógeno, hay 12 átomos en la izquierda y por tanto necesitamos escribir un 6 delante del H2O. De igual forma se ajustan también los átomos de O que son en total 14. Esto da finalmente:
CONCLUSIONES
- Las reacciones son todo proceso termodinámico en el cual dos o más sustancias, se transforman
- La ecuación química es una descripción simbólica de una reacción química
- Las reacciones químicas son un tema bastante amplio y para entenderlo con claridad se necesita mucho tiempo y dedicación
- Lo que nosotras creemos saber de la química es muy superficial
WEBGRAFÍA




















BUEN TRABAJO 5.0
ResponderEliminar