CORRECCIÓN GRUPOS 4,5,6 Y 7
INTRODUCCIÓN
En el presente trabajo se hablará sobre los grupos cuatro cinco seis y siete de la tabla periódica, de sus elementos, propiedades desde físicas a químicas, además de sus usos y aplicaciones para comprender de una manera mas sencilla el estudio de la química enfocada en la relación ciencia-cotidianidad; también se agregaron vídeos cortos explicativos sobre el tema para así entenderlo dinámicamente.








.jpg)


.jpg)






GRUPO 5






























OBJETIVOS
- Aprender a clasificar los elementos en metales, no metales y gases nobles.
- Conocer el criterio de clasificación de los elementos en el Sistema Periódico.
- Identificar los grupos de elementos más importantes.
- Conocer los símbolos de los elementos.

GRUPO 4
El grupo de carbono es un grupo de la tabla periódica integrado por los elementos: carbono (C), silicio (Si), germanio (Ge), estaño (Sn), plomo (Pb) En la notación moderna de la IUPAC se lo llama Grupo 14. En el campo de la física de los semiconductores, todavía es universalmente llamado Grupo IV.
Estos elementos forman más de la cuarta parte de la corteza terrestre y solo podemos encontrar en forma natural al carbono al estaño y al plomo en forma de óxidos y sulfuros, su configuración electrónica termina en ns2,p2.
Los elementos de este grupo presenta diferentes estados de oxidación y estos son: +2 y +4. los compuestos orgánicos presentan variedad en su oxidación Mientras que los óxidos de carbono y silicio son ácidos, los del estaño y plomo son anfótero, el plomo es un elemento tóxico.
Estos elementos no suelen reaccionar con el agua, los ácidos reaccionan con el germanio, estaño y plomo, las bases fuertes atacan a los elementos de este grupo, con la excepción del carbono, desprendiendo hidrógeno, reaccionan con el oxígeno formando óxidos.
Elementos del Grupo 4
- Carbono(C):
Es un elemento químico de número atómico 6, es un sólido a temperatura ambiente. Es el pilar básico de la química orgánica; se conocen cerca de 16 millones de compuestos de carbono, aumentando este número en unos 500.000 compuestos por año, y forma parte de todos los seres vivos conocidos. Forma el 0,2 % de la corteza terrestre.

- Características:
El carbono es un elemento que posee formas alotrópicas, un caso fascinante lo encontramos en el grafito y en el diamante, el primero corresponde a uno de las sustancias más blandas y el segundo a uno de los elementos más duros y otro caso con el carbón y el diamante, el carbón es tienen un precio comercial bastante bajo en cambio el diamante es conocido por ser una de las piedras mas costosas del mundo. Presenta una gran afinidad para enlazarse químicamente con otros átomos pequeños, incluyendo otros átomos de carbono con los que puede formar largas cadenas, y su pequeño radio atómico le permite formar enlaces múltiples. Así, con el oxígeno forma el dióxido de carbono, vital para el crecimiento de las plantas, con el hidrógeno forma numerosos compuestos denominados genéricamente hidrocarburos.

- Estados alotrópicos:
Se conocen cinco formas alotrópicas del carbono, una de las formas como encontramos el carbono es el grafito el grafito tienen exactamente la misma cantidad de átomos que el diamante la única variación que este presenta esta en la estructura la estructura del diamante es tetraédrica y la del grafito es mucho más sencilla. Pero por estar dispuestos en diferente forma, su textura, fuerza y color son diferentes.

- Aplicaciones:
El principal uso industrial del carbono es como un componente de hidrocarburos, especialmente los combustibles fósiles (petróleo y gas natural). Del primero se obtienen, por destilación en las refinerías, gasolinas, queroseno y aceites, siendo además la materia prima empleada en la obtención de plásticos. El segundo se está imponiendo como fuente de energía por su combustión más limpia.

- Silicio(Si):
Es un metaloide de numero atómico 14 de grupo A4. El silicio es el segundo elemento más abundante de la corteza terrestre (27,7% en peso) Se presenta en forma amorfa y cristalizada; el primero es un polvo parduzco, más activo que la variante cristalina, que se presenta en octaedros de color azul grisáceo y brillo metálico.

- Características:
En forma cristalina es muy duro y poco soluble y presenta un brillo metálico y color grisáceo. Aunque es un elemento relativamente inerte y resiste la acción de la mayoría de los ácidos, reacciona con los halógenos y álcalis diluidos. El silicio transmite más del 95% de las longitudes de onda de la radiación infrarroja.
Se prepara en forma de polvo amarillo pardo o de cristales negros-grisáceos. Se obtiene calentando sílice, o dióxido de silicio (SiO2), El silicio cristalino tiene una dureza de 7, suficiente para rayar el vidrio, de dureza de 5 a 7. El silicio tiene un punto de fusión de 1.411 °C, un punto de ebullición de 2.355 °C y una densidad relativa de 2,33(g/ml). Su masa atómica es 28,086 u
- Estados del silicio:
El silicio lo podemos encontrar en diversas formas en polvo, policristal ver y olivino
- Aplicaciones:
Se utiliza en aleaciones, en la preparación de las siliconas, en la industria de la cerámica técnica y, debido a que es un material semiconductor muy abundante, tiene un interés especial en la industria electrónica y microelectrónica como material básico para la creación de obleas o chips que se pueden implantar en transistores, pilas solares y una gran variedad de circuitos electrónicos. El silicio es un elemento vital en numerosas industrias.

- Germanio(Ge):
Elemento químico, metálico, gris plata, quebradizo, símbolo Ge, número atómico 32, peso atómico 72.59, punto de fusión 937.4ºC (1719ºF) y punto de ebullición 2830ºC (5130ºF), con propiedades entre el silicio y estaño. El germanio se encuentra muy distribuido en la corteza terrestre con una abundancia de 6.7 partes por millon (ppm). El germanio tiene una apariencia metálica, pero exhibe las propiedades físicas y químicas de un metal sólo en condiciones especiales, dado que está localizado en la tabla periódica en donde ocurre la transición de metales a no metales.
-
.jpg)
- Características:
Es un metaloide sólido duro, cristalino, de color blanco grisáceo lustroso, quebradizo, que conserva el brillo a temperaturas ordinarias. Presenta la misma estructura cristalina que el diamante y resiste a los ácidos y álcalis.
Forma gran número de compuestos organometálicos y es un importante material semiconductor utilizado en transistores y fotodetectores. A diferencia de la mayoría de semiconductores, el germanio tiene una pequeña banda prohibida (band gap) por lo que responde de forma eficaz a la radiación infrarroja y puede usarse en amplificadores de baja intensidad.

- Aplicaciones:
Las aplicaciones del germanio se ven limitadas por su elevado costo y en muchos casos se investiga su sustitución por materiales más económicos Fibra óptica. Electrónica: radares y amplificadores de guitarras eléctricas usados por músicos nostálgicos del sonido de la primera época del rock and roll; aleaciones SiGe en circuitos integrados de alta velocidad. También se utilizan compuestos sándwich Si/Ge para aumentar la movilidad de los electrones en el silicio (streched silicon).Óptica de infrarrojos: Espectroscopios, sistemas de visión nocturna y otros equipos. Lentes, con alto índice de refracción, de ángulo ancho y para microscopios. En joyería se usa la aleación Au con 12% de germanio.

- Estaño(Sn):
El estaño se conoce desde antiguo: en Mesopotamia se hacían armas de bronce, Plinio menciona una aleación de estaño y plomo, los romanos recubrían con estaño el interior de recipientes de cobre. Representa el 0,00023% en peso de la corteza. Raramente se encuentra nativo, siendo su principal mineral la casiterita (SnO2). También tiene importancia la estannita o pirita de estaño. La casiterita se muele y enriquece en SnO2 por flotación, éste se tuesta y se calienta con coque en un horno, con lo que se obtiene el metal. Para purificarlo (sobre todo de hierro) se eliminan las impurezas subiendo un poco por encima de la temperatura de fusión del estaño, con lo que éste sale en forma líquida.
.jpg)
- Características:
Es un metal, maleable, que no se oxida y es resistente a la corrosión. Se encuentra en muchas aleaciones y se usa para recubrir otros metales protegiéndolos de la corrosión. Una de sus características más llamativas es que bajo determinadas condiciones forma la peste del estaño.

- Formas alotrópicas:
El estaño puro tiene dos variantes alotrópicas: El estaño gris, polvo no metálico, conductor, de estructura cúbica y estable a temperaturas inferiores a 13,2 °C, que es muy frágil y tiene un peso específico más bajo que el blanco.

- Aplicaciones:
Se usa como revestimiento protector del cobre, del hierro y de diversos metales usados en la fabricación de latas de conserva. También se usa para disminuir la fragilidad del vidrio. Los compuestos de estaño se usan para fungicidas, tintes, dentífricos (SnF2) y pigmentos. Se usa para hacer bronce, aleación de estaño y cobre. Se usa para la soldadura blanda, aleado con plomo. Se usa en aleación con plomo para fabricar la lámina de los tubos de los órganos musicales. En etiquetas. Recubrimiento de acero. Se usa como material de aporte en soldadura blanda con cautín, bien puro o aleado. La directiva RoHS prohíbe el uso de plomo en la soldadura de determinados aparatos eléctricos y electrónicos. El estaño también se utiliza en la industria de la cerámica para la fabricación de los esmaltes cerámicos. Su función es la siguiente: en baja y en alta es un o pacificante. En alta la proporción del porcentaje es más alto que en baja temperatura.

- Plomo(Pb):
Es un elemento de la tabla periódica, cuyo símbolo es Pb y su número atómico es 82 Dmitri Mendeléyev químico no lo reconocía como un elemento metálico común por su gran elasticidad molecular. Cabe destacar que la elasticidad de este elemento depende de las temperaturas del ambiente, las cuales distienden sus átomos, o los extienden. El plomo es un metal de densidad relativa 11,45 a 16 °C tiene una plateada con tono azulado, que se empaña para adquirir un color gris mate. Es flexible, in-elástico y se funde con facilidad. Su fusión se produce a 326,4 °C y hierve a 1745 °C. Las valencias químicas normales son 2 y 4.

- Características:
Los compuestos de plomo más utilizados en la industria son los óxidos de plomo, el tetraetilo de plomo y los silicatos de plomo. Una de las características del plomo es que forma aleaciones con muchos metales como el calcio estaño y bronce, y, en general, se emplea en esta forma en la mayor parte de sus aplicaciones. Es un metal pesado y tóxico, y la intoxicación por plomo se denomina saturnismo o plumbosis.

- Aplicaciones:
El plomo se usa como cubierta para cables, ya sea la de teléfono, de televisión, de Internet o de electricidad, sigue siendo una forma de empleo adecuada. La ductilidad única del plomo lo hace particularmente apropiado para esta aplicación, porque puede estirarse para formar un forro continuo alrededor de los conductores internos.
Se utilizan una gran variedad de compuestos de plomo, como los silicatos, los carbonatos y sales de ácidos orgánicos, como estabilizadores contra el calor y la luz para los plásticos de cloruro de polivinilo. Se usan silicatos de plomo para la fabricación de frituras (esmaltes) de vidrio y de cerámica, las que resultan útiles para introducir plomo en los acabados del vidrio y de la cerámica. La asida de plomo, Pb(N3)2, es el detonador estándar para los explosivos plásticos como el C-4. Los arseniatos de plomo se emplean en grandes cantidades como insecticidas para la protección de los cultivos y para ahuyentar insectos molestos como lo son cucarachas, mosquitos y otros animales que posean un exoesqueleto. El litargirio (óxido de plomo) se emplea mucho para mejorar las propiedades magnéticas de los imanes de cerámica de ferrita de bario.

GRUPO 5
El grupo del nitrógeno está compuesto por los elementos químicos del grupo 15 de la tabla periódica, que son: nitrógeno (N), fósforo (P), arsénico (As), antimonio (Sb), bismuto (Bi) y el elemento sintético moscovio (Mc), cuyo descubrimiento ya ha sido confirmado. Estos elementos también reciben el nombre de pnicógenos o nitrogenoideos.
Sus elementos poseen 5 electrones de valencia, por lo tanto tienden a formar enlaces covalentes, y en ocasiones algunos forman enlaces iónicos (Sb y Bi). A medida que se desciende.
En este grupo el nitrógeno (N) y el fósforo (P) son no metales, el arsénico (As) y antimonio (Sb) son metaloides, y el bismuto (Bi) es un metal. El nitrógeno existe como gas diatómico (N2), forma numerosos óxidos, tiene tendencia a aceptar tres electrones y formar el ion nitruro N 3-
El fósforo existe como como moléculas de P4, forma dos óxidos sólidos de fórmulas P4O6 y P4O10. El arsénico, antimonio y bismuto tienen estructuras tridimensionales. El bismuto es con mucho un metal mucho menos reactivo que los de los grupos anteriores.


Sus elementos poseen 5 electrones de valencia, por lo tanto tienden a formar enlaces covalentes, y en ocasiones algunos forman enlaces iónicos (Sb y Bi). A medida que se desciende.
En este grupo el nitrógeno (N) y el fósforo (P) son no metales, el arsénico (As) y antimonio (Sb) son metaloides, y el bismuto (Bi) es un metal. El nitrógeno existe como gas diatómico (N2), forma numerosos óxidos, tiene tendencia a aceptar tres electrones y formar el ion nitruro N 3-
El fósforo existe como como moléculas de P4, forma dos óxidos sólidos de fórmulas P4O6 y P4O10. El arsénico, antimonio y bismuto tienen estructuras tridimensionales. El bismuto es con mucho un metal mucho menos reactivo que los de los grupos anteriores.
Elementos del Grupo 5
- Nitrogeno(N):
Elemento químico, símbolo N, número atómico 7, peso atómico 14.0067; es un gas en condiciones normales. El nitrógeno molecular es el principal constituyente de la atmósfera ( 78% por volumen de aire seco). Esta concentración es resultado del balance entre la fijación del nitrógeno atmosférico por acción bacteriana, eléctrica (relámpagos) y química (industrial) y su liberación a través de la descomposición de materias orgánicas por bacterias o por combustión. En estado combinado, el nitrógeno se presenta en diversas formas. Es constituyente de todas las proteínas (vegetales y animales), así como también de muchos materiales orgánicos. Su principal fuente mineral es el nitrato de sodio.
- Tiene reactividad muy baja.
- A temperaturas ordinarias reacciona lentamente con el litio.
- A altas temperaturas, reacciona con cromo, silicio, titanio, aluminio, boro, berilio, magnesio, bario, estroncio, calcio y litio para formar nitruros; con O2, para formar NO, y en presencia de un catalizador, con hidrógeno a temperaturas y presión bastante altas, para formar amoniaco.

- Obtención:
- El nitrógeno se obtiene a gran escala por destilación fraccionada de aire líquido.
- en el laboratorio se obtiene N2 de alta pureza por descomposición térmica de NaN3.
- Aplicaciones:
- La mayor parte del nitrógeno se utiliza en la formación de amoniaco. Ademas, el nitrógeno liquido se utiliza extensamente en criogenia para alcanzar bajas temperaturas y como gas para crear atmósferas inertes.
- obtención de fertilizantes.
- se usa en pequeñas cantidades en lamparas
- es componente básico del ácido nítrico, amoniaco, cianamidos, tintes, compuestos de colado o de plásticos derivados de la urea.
- cianuros y nitruros para cubiertas endurecedoras de metales y numerosos compuestos orgánicos sintéticos y otros nitrogenados.

- Fósforo(P):
Existen 3 formas alotrópicas más importantes que son: blanco, negro y rojo.
- Fósforo blanco:
Es muy venenoso, insoluble en agua pero soluble en benceno y sulfuro de carbono. Es una sustancia muy reactiva, su inestabilidad tiene su origen en el ángulo de 60º de las unidades P4. Es la más reactiva de todas las formas alotrópicas.
Es cinéticamente inerte y no arde al aire incluso a 400°C.
- Fósforo rojo:
No es venenoso, insoluble en todos los disolventes y arde al aire por encima de los 400°C. Reacciona con los halógenos con menor violencia. Tiene una estructura polimérica con tetraedros P4 unidos entre sí.

- Obtención.
- Fósforo blanco:
Se obtiene al calentar Ca3(PO4)2 con arena (SiO2) y coque a 1400°C
- Fósforo negro:
Resulta de calentar el fósforo blanco a altas presiones.
- Fósforo rojo:
Se obtiene calentando el blanco en atmósfera inerte a 250°C.


- Aplicaciones:
- El fósforo blanco se utiliza como incendiario, pero los compuestos de fósforo más empleados son el ácido fosfórico y los fosfatos.
- Acero: desoxidante; aumenta la resistencia y la resistencia a la corrosión ayudan a que las laminas de acero no se peguen entre sí.
- Bronce: Desoxidante; incrementa la dureza.
- Cobre: Desoxidante , incrementa la dureza y la resistencia; reduce la conductividad eléctrica.
- Latón: Desoxidante
- Pigmentos colorantes: Azules, verdes.
- Vidrio: vidrio especial resistente al ácido fluorhídrico; opacador.
- Textiles: Mordente.
Los fósforos blanco y rojo se obtienen comercialmente, pero tienen pocos usos, ademas de los de producir fuego.
El fósforo no se encuentra libre en la naturaleza. Sin embargo, sus compuestos abundan y están distribuidos ampliamente; se encuentran en muchos yacimientos de roca y minerales.
El fósforo es uno de los elementos esenciales para el crecimiento y desarrollo de las plantas.
- Arsénico(As):
El arsénico se encuentra en cuatro formas alotrópicas metálica o arsénico alfa, gris, parda y amarilla. Tiene propiedades a la vez metálicas y no metálicas. Se sublima a 450 °C, sin fundir, dando vapores amarillos. El arsénico amarillo, por la acción de la luz, pasa a la forma parda y finalmente, a la gris. El arsénico metálico arde a 180 °C desprendiendo un olor a ajo muy característico, que permite reconocer hasta tazas de arsénico.
El arsénico es un metal de color gris de plata, extremadamente frágil y cristalizado que se vuelve negro al estar expuesto al aire. Es inadecuado para el uso común de los metales dada su toxicidad (extremadamente venenoso). es considerado como un elemento perjudicial en las aleaciones, ya que tiende a bajar el punto de fusión y a causar fragilidad.

- Aplicaciones:
- El arsénico se usa en aleaciones no ferrosas para aumentar la dureza de las aleaciones de plomo facilitando la fabricación de perdigones
- Se aplica en la elaboración de insecticidas ( arseniato de calcio y plomo), herbicidas, raticidas y fungicidas
- Fabricación de vidrio, textiles, papeles, adhesivos de metal, preservantes de alimentos, procesos de bronceado y conservación de pieles
- El arsénico de máxima pureza se utiliza para la fabricación de semiconductores
- Se aplica en la elaboración de insecticidas ( arseniato de calcio y plomo), herbicidas, raticidas y fungicidas
- Se utiliza como colorantes de algunas pinturas y papeles en cerámicas y vidriería..
- Se usa en la industria de la pirotecnia para la preparación de bengalas .
- Se encuentra comercialmente como metal en forma de terrones, en polvo o aleaciones.

- Antimonio(Sb):
El antimonio no es un elemento abundante en la naturaleza, muy rara vez se encuentra en forma natural y con frecuencia se encuentra como una mezcla isomorfa con arsénico (allemonita). Su símbolo Sb se obtiene de la palabra Stibium. Es duro, frágil y cristalizado que no es ni maleable ni dúctil. Se encuentra en dos formas: amarilla y gris. La forma amarilla es metaestable y se compone de moléculas Sb4, la forma gris es metálica, la cual cristaliza en capas formando una estructura romboédrica.
El antimonio tiene una conductividad eléctrica menos en estado sólido que en estado líquido lo cual lo hace diferente a los metales normales, en forma metálica es muy quebradizo, de color blanco-azuloso con un brillo metálico característico, de apariencia escamosa.

- Aplicaciones:
- Producción de diodos, detectores infrarrojos y dispositivos de efecto Hall.
- Es usado como un aleante, ya que incrementa mucho la dureza y resistencia a esfuerzos mecánicos de la aleación. Aleaciones como Peltre, metal antifricción (con estaño), etc.
- Baterías, acumuladores, recubrimiento de cables, cojinetes y rodamientos.
- Sus compuestos en forma de óxidos se utilizan para la fabricación de materiales resistentes al fuego, tales como: esmaltes, vidrios, pinturas y cerámicos.
- El más importante de los compuestos en forma de óxido es el trióxido de antimonio el cual se usa principalmente como retardante de llama.
El antimonio se obtiene calentando el sulfuro con hierro, o calentando el sulfuro y el sublimado Sb4O6 obtenido se reduce con carbono. El antimonio de alta pureza se produce por refinado electrolítico.

- Bismuto(Bi):
Es un metal pesado (es el elemento más metálico de este grupo), de color blanco grisáceo y cristalizado que tiene brillo muy apreciable. Es una de los pocos metales que se dilatan en su solidificación, también es el más diamagnético de todos los metales y su conductividad térmica es menor que la de otros metales (excepto la del mercurio). Se oxida ligeramente cuando esta húmedo y es inerte al aire seco a temperatura ambiente, cuando supera su punto de fusión se forma rápidamente una película de óxido.

- Aplicaciones:
- Manufactura de compuestos farmacéuticos.
- Manufactura de aleaciones de bajo punto de fusión.
- Se utiliza en rociadoras automáticas, sellos de seguridad para cilindros de gas comprimido, soldaduras especiales.
- Las aleaciones que se expanden al congelarse se usan en fundición y tipos metálicos.
Se encuentra naturalmente como metal libre y en minerales, sus principales depósitos se encuentran en suramerica, aunque en norteamerica se obtiene como subproducto del refinado de minerales de plomo y cobre.

GRUPO 6
El grupo de los anfígenos o calcógenos es también llamado familia del oxígeno y es el grupo conocido antiguamente como VI A, y actualmente el grupo 16 (según la IUPAC) en la tabla periódica de los elementos, formado por los siguientes elementos: oxígeno (O), azufre (S), selenio (Se), telurio (Te) y polonio (Po). El nombre de anfígeno en español deriva de la propiedad de algunos de sus elementos de formar compuestos con carácter ácido o básico.
Aunque todos ellos tienen seis electrones de valencia (última capa s2p4),1 sus propiedades varían de no metálicas a metálicas en cierto grado, conforme aumenta su número atómico.
El oxígeno y el azufre se utilizan abiertamente en la industria y el telurio y el selenio en la fabricación de semiconductores.
- Oxígeno(O):
El oxígeno es el elemento más abundante en el planeta tierra. Existe en estado libre, como O2, en la atmósfera (21% en volumen), pero también combinado en el agua y formando parte diversos óxidos y oxosales, como silicatos, carbonatos, sulfatos, etc.
En condiciones ordinarias el oxígeno se presenta en dos formas alotrópicas, el dioxígeno y el ozono, de los cuales sólo el primero es termodinámicamente estable.
A diferencia del oxígeno, que se presenta en su variedad más estable como molécula diatómica O2 derivada de un enlace doble, los demás presentan estructuras derivadas de enlaces sencillos. Esto es debido a la disminución de la eficacia del solapamiento lateral a medida que aumenta el tamaño de el.
- Obtención
Industrialmente, se obtiene de la destilación fraccionada del aire líquido. A escala de laboratorio, existen diversos métodos de obtención:
- Electrólisis de disoluciones acuosas alcalinas.
- Descomposición catalítica de H2O2.
- Descomposición térmica de cloratos.

- Azufre(S)
El azufre se encuentra: nativo (en zonas volcánicas y en domos de sal) ó combinado, en sulfatos, sulfuros (sobre todo pirita, FeS2) y sulfuro de hidrógeno (acompañando al petróleo).

- Variedades alotrópicas y sus propiedades físicas:
- En estado sólido.
- Variedades rómbica y monoclínica (anillos S8), azufre plástico (cadenas Sn).
- En estado líquido.
- Anillos S8 y cadenas de longitud variable.
- En fase gas.
- Cicloazufre, cadenas Sn (n = 3-10), S2

- Propiedades y Usos:
El azufre es el segundo elemento no metal del grupo. a temperatura ambiente es un solido amarillo palido que se encuentra libre en la naturaleza. lo conocían los antiguos y se le menciona en el libro del genesis como piedra de azufre. las moléculas de azufre contienen ocho atomos de azufre conectados a un anillo; su formula es s8 . el azufre tiene una importancia especial en la manufactura de neumáticos de hule y acido sulfurico, H2SO4 . Otros compuestos de azufre son importantes para blanquear frutos y granos
Se usa en muchos procesos industriales como la producción de ácido sulfúrico (sustancia química más importante a nivel industrial), en la fabricación de pólvora y el vulcanizado del caucho. Algunos compuestos como los sulfitos tienen propiedades blanqueadoras, otros tienen uso medicinal (sulfas, sulfato de magnesio). También se utiliza en la elaboración de fertilizantes y como fungicida.

- Selenio(Se):
Elemento químico de número atómico 34, masa atómica 78,96 y símbolo Se ; es un elemento semimetálico sólido de color gris brillante, de características parecidas a las del azufre, que se emplea en instalaciones eléctricas por ser buen conductor de la electricidad.

- El Selenio presenta tres formas Alotrópicas:
- Se rojo: constituido por moléculas Se8.
- Se negro: anillos Sen con n muy grande y variable (forma amorfa).
- Se gris: de estructura similar a la del azufre plástico. Este alótropo presenta aspecto metálico (es un semimetal) y es fotoconductor.

- Propiedades y Usos:
La conductividad de este elemento aumenta con la intensidad de la luz. a causa de esta fotoconductividad, el selenio se a utilizado en los medidores de luz para camaras fotograficas y en fotocopiadoras, pero la preocupación que origina su toxicidad ha hecho que disminuya su uso. el selenio tambien puede convertir la corriente electrica alterna en corriente directa; se ha utilizado en rectificadores, como los convertidores que se usan en los radios y grabadores portátiles, y en herramientas electricas recargables. el color rojo que el selenio imparte al vidrio lo hace util en la fabricación de lentes para señales luminosas.
Se utiliza básicamente en electricidad y electrónica, como en células solares y rectificadores. Se añade a los aceros inoxidables y es catalizador de reacciones de deshidrogenación. Algunos compuestos se emplean en la fabricación del vidrio y esmaltes. Los sulfuros se usan en medicina veterinaria y champús. El dióxido de selenio es un catalizador muy utilizado en reacciones de oxidación, hidrogenación y deshidrogenación de compuesos orgánicos.

- Telurio(Te)
Presenta una única variedad alotrópica, el Te gris, similar al Se gris. Tiene un carácter más metálico que el anterior.

- Propiedades y usos:
El telurio, tiene aspecto metalico, pero es un metaloide en el que predominan las propiedades no metalicas. se emplea en semiconductores y para endurecer las placas de los acumuladores de plomo y el hierro colado. se presenta en la naturaleza en diversos compuestos, pero no es abundante. el polonio es un elemento radiactivo poco comun que emite radiación alfa y gama; su manejo es muy peligroso. los usos de este elemento se relacionan con su radiactividad, y fue descubierto por marie curie, quien le dio este nombre en honor a su natal polonia.
Se emplea para aumentar la resistencia a la tensión en aleaciones de cobre y plomo y en la fabricación de dispositivos termoeléctricos. También se utiliza como agente vulcanizador y en la industria del vidrio. El telurio coloidal es insecticida y fungicida.

- Polonio(Po)
Presenta dos alótropos: cúbico simple y romboédrico, en los que que cada átomo está directamente rodeado por seis vecinos a distancias iguales (d0=355pm). Ambos alótropos tienen carácter metálico.
Los elementos de este grupo muestran una transición paulatina desde las propiedades típicamente covalentes en la parte alta del grupo hasta las típicamente metálicas del elemento más pesado; y constituyen un excelente ejemplo de como los modelos de enlace covalente y metálico son, únicamente, casos extremos imaginarios de una situación real más compleja de interpretar. Este aumento se pone de manifiesto no solo en la variación progresiva de sus propiedades físicas y químicas sino también en cambios en sus estructuras.

- Usos:
- los isótopos constituyen una fuente de radiación alfa. Se usan en la investigación nuclear. Otro uso es en dispositivos ionizadores del aire para eliminar la acumulación de cargas electrostáticas.
- Se utiliza también en dispositivos destinados a la eliminación de carga estática, en cepillos especiales para eliminar el polvo acumulado en películas fotográficas y también en fuentes de calor para satélites artificiales o sondas espaciales.

GRUPO 7
Los halógenos (del griego, formador de sales) son los elementos químicos que forman el grupo 17 (XVII A, utilizado anteriormente) o grupo VII A de la tabla periódica: flúor (F), cloro (Cl), bromo (Br), yodo (I), astato (At) y téneso (Ts). Este último también está en los metales del bloque.
En su última capa tienen siete electrones, dos en una subcapa s y cinco en subcapas p. El Flúor es el elemento con mayor tendencia a ganar electrones (ningún otro puede quitárselos), y su única valencia es 1. Es el único elemento que no logra, por lo expuesto, formar óxidos con el Oxígeno, el segundo en el ránking de electronegatividad. Los restantes tienen opciones entre las valencias 1, 3, 5 y 7. Los cuatro primeros son no metales en tanto que el Astato se comporta como metal. En condiciones normales de presión y temperatura (1 atmósfera y 0°C, respectivamente), el Flúor y el Cloro son gaseosos, el Bromo es líquido, y los restantes son sólidos. Los halógenos se desplazan mutuamente de los compuestos a medida que aumenta su electronegatividad (de abajo hacia arriba en la tabla): es que está más arriba desplaza al que está más abajo. Con los metales producen sales iónicas. Con gas hidrógeno forman haluros que, al disolverse en agua, generan hidrácidos (ácidos no oxigenados).
Elementos del Grupo 7
- Flúor(F):
El flúor es el elemento químico de número atómico 9 situado en el grupo de los halógenos (grupo 17) de la tabla periódica de los elementos. Su símbolo es F.
Es un gas a temperatura ambiente, de color amarillo pálido, formado por moléculas diatómicas F2. Es el más electronegativo y reactivo de todos los elementos. En forma pura es altamente peligroso, causando graves quemaduras químicas al contacto con la piel.
- Obtención:
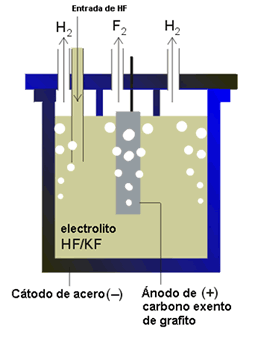
- Mediante electrólisis de fluoruro ácido de potasio anhidro (KF · 3HF) fundido a temperaturas entre 70 - 130 ºC.
- Como subproducto en la síntesis de ácido fosfórico y superfosfatos.

- Aplicaciones:
- Enriquecimiento del isótopo fisionable 235U, mediante formación del hexafluoruro de uranio y posterior separación por difusión gaseosa.
- Propelente de cohetes.
- El ácido fluorhídrico se emplea para: grabado de vidrio, tratamiento de la madera, semiconductores y en la fabricación de hidrocarburos fluorados.
- En pequeñas cantidades, el ion fluoruro previene la caries dental. el ion fluoruro facilita la formación de fluoroapatito, Ca5(PO4)3F, en lugar de apatito, Ca5(PO4)3(OH), más soluble en ácidos. Debe añadirse al agua para impedir la caries (se añade en forma de Na2SiF6, NaF y HF en concentraciones de 1 mg / l).
- El hexafluoruro de azufre se utiliza como material dieléctrico.
- La criolita, Na2AlF6 se utiliza como electrólito en la metalurgia del aluminio.
- El fluoruro de calcio se introduce en alto horno y reduce la viscosidad de la escoria en la metalurgia del hierro.

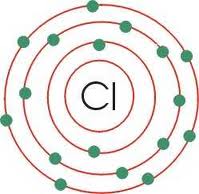
- Cloro(Cl):
El cloro es un elemento químico de número atómico 17 situado en el grupo de los halógenos (grupo VIIA) de la tabla periódica de los elementos. Su símbolo es Cl. En condiciones normales y en estado puro forma dicloro: un gas tóxico amarillo-verdoso formado por moléculas diatómicas (Cl2) unas 2,5 veces más pesado que el aire, de olor desagradable y tóxico. Es un elemento abundante en la naturaleza y se trata de un elemento químico esencial para muchas formas de vida.

- Obtención:
Electrólisis de cloruros o del ácido clorhídrico. Se obtiene como subproducto de la obtención de metales alcalinos y alcalino-térreos.

- Aplicaciones:
- Potabilizar y depurar el agua para consumo humano.
- Producción de papel, colorantes ,textiles, productos derivados del petróleo, antisépticos, insecticidas, medicamentos, disolventes, pinturas, plásticos, etc.
- En grandes cantidades, el cloro es consumido, para: productos sanitarios, blanqueantes, desinfectantes y productos textiles.
- Producción de ácido clorhídrico, cloratos (usados como oxidantes, fuentes de oxígeno en fósforos en explosivos), cloroformo y tetracloruro de carbono (estas dos últimas sustancias se emplean para obtener refrigerantes, propulsores y plásticos).
- En la extracción de bromo.

- Bromo(Br):
El bromo (también llamado antaño fuego líquido) es un elemento químico de número atómico 35 situado en el grupo de los halógenos (grupo VII A) de la tabla periódica de los elementos. Su símbolo es Br.
El bromo a temperatura ambiente es un líquido rojo, volátil y denso. Su reactividad es intermedia entre el cloro y el yodo. En estado líquido es peligroso para el tejido humano y sus vapores irritan los ojos y la garganta.

- Obtención:
- Oxidación de bromuros con cloro. El bromo que se obtiene se condensa, destila y deseca.
- En el laboratorio se obtiene por acción del ácido sulfúrico sobre bromuro potásico con dióxido de manganeso como catalizador.

- Aplicaciones:
- Su principal aplicación es la obtención del 1,2-dibromoetano, CH2Br-CH2Br, que se añade a la gasolina para evitar que los óxidos de plomo se depositen en los tubos de escape, ya que reacciona con el plomo para formar dibromuro de plomo, volátil, que sale al aire y provoca graves problemas de salud. La reducción del plomotetraetilo (antidetonante) en las gasolinas ha afectado seriamente a la producción de bromo.
- El bromuro de metilo se emplea como fumigante.
- El hexabromobenceno y el hexabromociclododecano se emplean como agentes antiinflamables.
- El bromo se emplea en la fabricación de fibras artificiales.
- El bromo se usa para la desinfección de aguas de piscinas.
- Los bromuros inorgánicos (bromuro de plata) se emplean en fotografía.

- Yodo( I ):
es un elemento químico de número atómico 53 situado en el grupo de los halógenos (grupo 17) de la tabla periódica de los elementos. Este elemento puede encontrarse en forma molecular como yodo diatómico.
Es un oligoelemento y se emplea principalmente en medicina, fotografía y como colorante. Químicamente, el yodo es el halógeno menos reactivo y electronegativo. Como con todos los otros halógenos (miembros del Grupo XVII en la tabla periódica), el yodo forma moléculas diatómicas y por ello forma el diyodo de fórmula molecular

- Obtención:
- Mediante reacción química del yodato de calcio con dióxido de azufre.
- Por extracción de las cenizas de algas.
- Para obtenerlo ultrapuro se hace reaccionar yoduro potásico con sulfato de cobre.

- Aplicaciones:
- El yodo se emplea como desinfectante de aguas, catalizador en la fabricación de gomas y colorantes.
- El yoduro de plata se emplea en fotografía.
- Se emplea en medicina: ingestión de yoduros y tiroxina (que contiene yodo), el agua de yodo se emplea como desinfectante de heridas.
- Se adiciona, en forma de yoduro, a la sal de mesa, para evitar carencias alimentarias y posibles problemas de bocio.

- Astato(At):
El ástato o astato es un elemento químico de la tabla periódica cuyo símbolo es At y su número atómico es 85. Es radiactivo y el más pesado de los halógenos. Se produce a partir de la degradación de uranio y torio.
- Obtención:
Se obtiene de la misma manera en que se hizo inicialmente, es decir, bombardeando el isótopo 209-Bi con partículas alfa. Es muy escaso.
- Aplicaciones:
No tiene.
WEBGRAFÍA
- https://es.wikipedia.org/wiki/Grupo_del_Carbono
- http://grupo4tabla.blogspot.com/2013/05/imagen-tabla-periodica-grupo-iva-tabla.html
- https://es.wikipedia.org/wiki/Grupo_del_nitr%C3%B3geno
- http://vaenmateriales.blogspot.com/
- https://es.wikipedia.org/wiki/Anf%C3%ADgeno
- https://www.ecured.cu/Grupo_VI_A
- https://es.wikipedia.org/wiki/Hal%C3%B3geno
- http://conceptosdequimica.blogspot.com/2009/07/tabla-periodica-grupo-vii.html
- http://vaenmateriales.blogspot.com/
- https://es.wikipedia.org/wiki/Anf%C3%ADgeno
- https://www.ecured.cu/Grupo_VI_A
- https://es.wikipedia.org/wiki/Hal%C3%B3geno
- http://conceptosdequimica.blogspot.com/2009/07/tabla-periodica-grupo-vii.html







PUDO HABER CONSULTADO UN POCO MAS 4,0
ResponderEliminarEL JUEGO ALGUNAS IMAGENES NO SE DISTINGUEN 4,0
DEFINITIVA 4,0