NOMENCLATURA DE LOS ALCOHOLES Y FENOLES
INTRODUCCIÓN
La Química Orgánica es la rama de la química que estudia una clase numerosa de moléculas que contienen carbono formando enlaces covalentes carbono-carbono o carbono-hidrógeno, algunos grupos funcionales son : alcohol, éter, aldehído, cetona, entre otros.
Los Alcoholes son una serie de compuestos que poseen un grupo hidroxilo, -OH, unido a una cadena carbonada; este grupo OH está unido en forma covalente a un carbono con hibridación.
Los Fenoles son compuestos orgánicos que están formados por uno o varios Grupos Funcionales Hidroxilo (-OH) unidos a un anillo aromático (anillo de benceno).
En el presente trabajo les daremos a conocer sobre la química orgánica con respecto a un grupo funcional, los Alcoholes y un compuesto orgánico aromático, los Fenoles, en donde hablaremos todo sobre su clasificación, nomenclatura y propiedades.


OBJETIVOS
- Identificar los alcoholes y fenoles.
- Comprender la nomenclatura de los alcoholes y fenoles.
- Realizar ejercicios de nomenclatura de alcoholes y fenoles para entender de mejor forma la temática.
- Fortalecer los temas vistos en clase.

MARCO TEÓRICO
Los alcoholes son compuestos orgánicos que contienen un grupo hidróxilo (-OH), que se encuentra unido a una cadena hidrocarbonada a través de un enlace covalente a un átomo de carbono con hibridación sp3, mientras que los compuestos que poseen un grupo hidróxilo unido a uno de los átomos de carbono de un doble enlace se conocen como enoles, y los compuestos que contienen un grupo hidróxilo unido a un anillo de benceno se llaman fenoles.

ALCOHOLES
- CLASES DE ALCOHOLES:
Los alcoholes se clasifican en primarios, secundarios y terciarios, dependiendo del carbono funcional al que se una el grupo hidroxilo.

- Alcohol primario:
Se utiliza la Piridina (Py) para detener la reacción en el aldehído Cr03 / H+ se denomina reactivo de Jones, y se obtiene un ácido carboxílico.
- Alcohol secundario:
se obtiene una cetona + agua.
- Alcohol terciario:
si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza uno enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano.
A su vez los alcoholes se pueden clasificar según el número de grupos hidroxilos que contenga el compuesto:
- Monoalcohol o Monol: Son alcoholes que tienen un solo grupo hidroxilo (–OH), y son aquellos que pueden clasificarse como alcoholes primarios, secundarios y terciarios.

- Polialcoholes: Son compuestos que tienen dos o más grupos hidroxilos (–OH).

- NOMENCLATURA DE ALCOHOLES:
1. Se elige como cadena principal la de mayor longitud que contenga el grupo -OH.

2. Se numera la cadena principal para que el grupo -OH tome el localizador más bajo. El grupo hidroxilo tiene preferencia sobre cadenas carbonadas, halógenos, dobles y triples enlaces.

3. El nombre del alcohol se construye cambiando la terminación -o del alcano con igual número de carbonos por -ol
4. Cuando en la molécula hay grupos grupos funcionales de mayor prioridad, el alcohol pasa a serun mero sustituyente y se llama hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos, anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos y cetonas.

5. El grupo -OH es prioritario frente a los alquenos y alquinos. La numeración otorga el localizador más bajo al -OH y el nombre de la molécula termina en -ol.

- PROPIEDADES FÍSICAS DE LOS ALCOHOLES:
- Solubilidad en el Agua:
Gracias al grupo -OH característico de los alcoholes, se pueden presentar puentes de hidrógeno, que hace que los primeros alcoholes sean solubles en el agua, mientras que a mayor cantidad de hidrógeno, dicha característica va desapareciendo debido a que el grupo hidroxilo va perdiendo significancia y a partir del hexanol la sustancia se torna aceitosa.
- Punto de Ebullición:
Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones. Todo esto se presenta porque el grupo OH al tener puentes de hidrógeno, son mas difíciles de romper.
- Punto de Fusión:
Presenta el mismo comportamiento que el punto de ebullición aumenta a medida que aumenta el numero de carbonos.
- Densidad:
Aumenta conforme aumenta el numero de carbonos y las ramificaciones de las moléculas.
- PROPIEDADES QUÍMICAS DE LOS ALCOHOLES:
- Oxidación:
La oxidacion es la reacción de alcoholes para producir ácidos carboxilicos, cetonas o aldehídos dependiendo de el tipo de alcohol y de catalizador, puede ser:
1) La reacción de un alcohol primario con ácido crómico (CrO3) en presencia de piridina produce un aldehído:

2) La reacción de un alcohol primario en presencia del reactivo de jones produce un ácido carboxilo:

3) La reacción de un alcohol secundario en presencia de permanganato de potasio produce una cetona:

- Deshidrogenación:
Los alcoholes primarios y secundarios cuando se calientan en contacto con ciertos catalizadores, pierden átomos de hidrógeno para formar aldehídos o cetonas. Si esta deshidrogenación se realiza en presencia de aire (O) el hidrógeno sobrante se combina con el oxígeno para dar agua.

- Halogenación:
El alcohol reacciona con el ácido hidrácido para formar haluros de alquilo mas agua:
R-OH + HX -------------------) R-X + H2O
- Deshidratación:
Es una propiedad de los alcoholes mediante la cual podemos obtener eteres o alquenos:
2 R -CH2OH ----------------) R - CH2 - O - CH2 - R'
R-R-OH ------------) R=R + H2O
- Reacción con Cloruro de Tionilo:
El cloruro de tionilo (SOCl2) se puede usar para convertir alcoholes en el correspondiente cloruro de alquilo en una reacción simple que produce HCl gaseoso y SO2.
FENOLES
“Los fenoles tienen propiedades similares a la de los alcoholes, pero algunas de ellas, derivan mas que nada del anillo aromático al que se encuentran enlazados.”
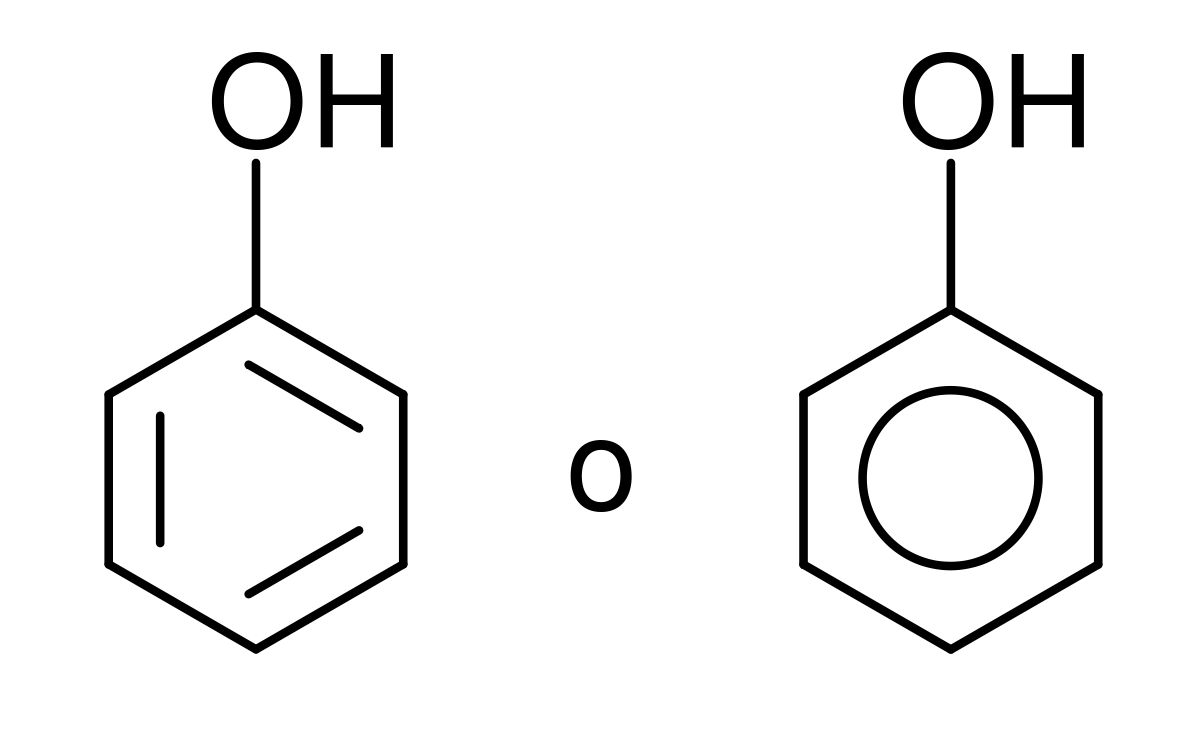
- NOMENCLATURA DE FENOLES:
- ¿Como se nombran?
1. Se nombran como los alcoholes, con la terminación "-ol" añadida al nombre del hidrocarburo, cuando el grupo OH es la función principal. Cuando el grupo OH no es la función principal se utiliza el prefijo "hidroxi-" acompañado del nombre del hidrocarburo.
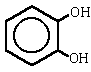
1,2-bencenodiol o benceno-1,2-diol (según normas IUPAC de 1993)
2. Si el benceno tiene varios sustituyentes, diferentes del OH, se numeran de forma que reciban los localizadores más bajos desde el grupo OH, y se ordenan por orden alfabético. En caso de que haya varias opciones decidirá el orden de preferencia alfabético de los radicales.
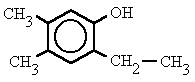
2-etil-4,5-dimetilfenol
3. Para nombrar a los fenoles si se deben seguir cierto tipo de criterios, dado que incluye un anillo aromatico. Con frecuencia se siguen los siguientes criterios:
- ORTO (1,2- disustituido)
- META (1,3- disustituido)
- PARA (1,4- disustituido)

- Si nos dan la fórmula
Comienza a contar por el grupo OH y en el sentido en que se consigan localizadores más bajos para los radicales. Nombra los radicales con los localizadores seguidos de benceno terminado en -ol.
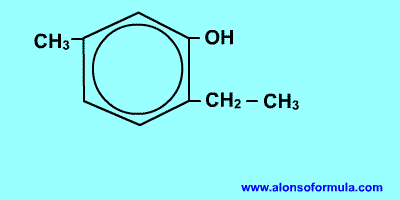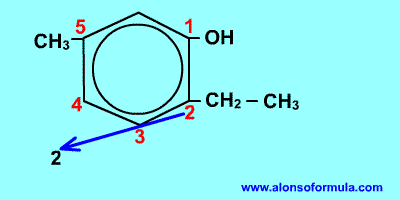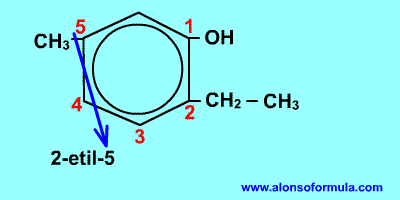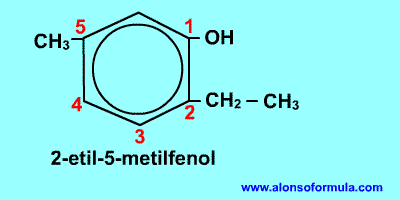
- Si nos dan el nombre
Sobre el benceno coloca los localizadores para situar los radicales y los grupos OH. Completa luego los hidrógenos que falten.

- PROPIEDADES FÍSICAS DE LOS FENOLES:
Los fenoles presentan algunas propiedades semejantes a los alcoholes, debido a la presencia del grupo –OH. Sin embargo conforman otra familia química y la mayoría de sus propiedades y los métodos para su obtención son diferentes.
Los fenoles más sencillos son líquidos o sólidos blandos e incoloros y se oxidan con facilidad por lo que se encuentran coloreados. En presencia de impurezas o bajo influencia de la luz, el aire y ciertos compuestos como el cobre y el hierro, el fenol puede teñirse de amarillo, marrón o rojo.
Fenol
- Solubilidad:
El fenol es poco soluble en agua ya que aunque presentan el puente de hidrógeno, la proporción de carbonos con respecto a la cantidad de –OH es muy baja.
Para que los compuestos que contienen grupos –OH sean solubles en agua la razón entre carbonos y grupos –OH no debe ser mayor de 3:1. El fenol es el miembro más pequeño de este grupo y contiene 6 átomos de carbono y sólo uno de -OH.
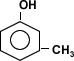
M-cresol (Monofenol)

p-dihidroxibenceno
(Difenol)
Los demás monofenoles poseen mayor número de carbonos y sólo un grupo OH, por ello son insolubles en agua. Los difenoles y polifenoles con más de un grupo –OH presentan mayor solubilidad en el agua.
- Punto de Ebullición
- Punto de Fusión
- PROPIEDADES QUÍMICAS DE LOS FENOLES:
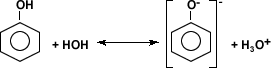
- Constantes de acidez:
Agua 1 x 10-14
Alcoholes 10-16 a 10-18
Fenol 1,1 x 10-10
Ácidos carboxílicos 10-5
Si se comparan las constantes de acidez de los fenoles con las del agua, los alcoholes y los ácidos carboxílicos, se puede concluir que los fenoles son ácidos más fuertes que el agua y que los alcoholes, pero más débiles que los ácidos carboxílicos.
El fenol presenta cinco estructuras contribuyentes, es decir que pueden ceder protones. Dos de estas estructuras corresponden a la resonancia del anillo bencénico. La resonancia viene dada por la ubicación de los dobles enlaces dentro de la molécula.
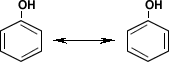
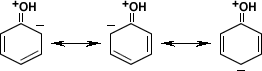
Las otras tres estructuras son posibles debido al carácter básico del oxígeno que le permiten compartir más de un par de electrones con el anillo.
- Síntesis del Fenol:
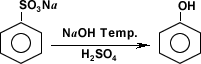
Existen varios métodos para obtener compuestos fenólicos, entre ellos se cuentan la hidrólisis del clorobenceno, obtención a partir del benceno-sulfonato de sodio y la oxidación del isopropil-benceno.
- Hidrólisis del clorobenceno:
para obtener el fenol, el clorobenceno se trata con una solución de hidróxido de sodio a ebullición y alta presión para obtener fenóxido de sodio. El fenóxido de sodio es una sal que reacciona con el ácido clorhídrico para formar fenol.
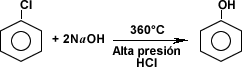
- Producción de fenol a partir de benceno-sulfonato de sodio:
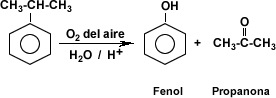
- Oxidación del isopropil benceno:
A partir del fenol es posible producir otros compuestos químicos, su carácter ácido le permite ceder un protón para formar así sales y éteres.
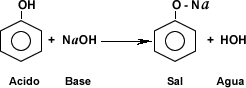
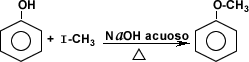
Otras reacciones como la esterificación, la halogenqación, la nitratación, la sulfonación permiten obtener productos químicos como ésteres, halógenos, productos nitrogenados y ácidos sulfónicos entre otros.

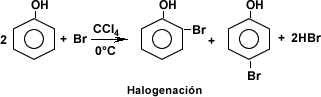
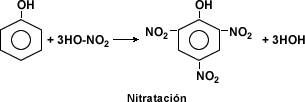
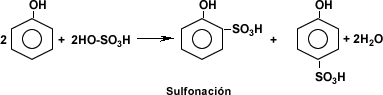




IDENTIFICACIÓN DE COMPUESTOS
WEBGRAFÍA
- https://es.slideshare.net/melisa082009/nomenclatura-de-alcoholes-79681268
- https://www.monografias.com/trabajos96/quimica-organica-alcoholes/quimica-organica-alcoholes.shtml
- https://www.quimicaorganica.org/alcoholes/410-nomenclatura-de-alcoholes.html
- http://www.quimicaorganica.net/nomeclatura-alcoholes.html
- http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_fenoles.htm

BUEN TRABAJO 4,5
ResponderEliminar